"����+��֪"˫�ر������ƶ��ҹ����Ӳ������Ŀ������
• ������Ͷ��Ӳ�������������ҩ�����III���о�֤ʵ���������β-1a��ȣ��������ǿ��������ͼ��������� MRI��������ͬʱ��������Ч���ٻ�����������ʧ�����ƻ�����֪���ܣ�����"����+��֪"˫�ر���
• ����������һ�������ʰ���1-���ᣨS1P��������ڼ���������ѡ���Ե���S1P��������1��5��S1P1��S1P5�����
• ���������ǰ�ʱ��ʩ���й������������������������Ĵ����Ʒ�����־�Ű�ʱ��ʩ���й���ʽ��������ѧ����
��ʱ��ʩ���й�������������������ѡ�����ʰ���1-���ᣨS1P��������ڼ���������®���������Ī�½��ң�����й�����ҩƷ�ල�����������������Ƴ��˸����Ͷ��Ӳ���������ٴ������ۺ���������-�����Ͷ��Ӳ���ͻ�Լ̷���չ�Ͷ��Ӳ�������ǰ�ʱ��ʩ���й������������������������Ĵ����Ʒ�������Ϊ�й����Ӳ�����ߴ���"����+��֪"˫�ر��������·�����
���Ӳ����һ����������ϵͳ���������ʲ���Ϊ��Ҫ�ص�����߽鵼�Լ���[1]����������£�����ά�⸲����һ���𱣻����ú�ά���������������ܵ����ʣ������ڵ���������ľ�ԵͿ�㡣�����Ӳ�����ߵ�����ϵͳ�ṥ����Щ���������ʣ���ʹ�������䣬���µ��ź���������ϸ���䴫��[2],[3]��������"�źű���"���ܵ��¶��Ӳ��֢״�����ͼ�������[2],[4]�����ְ����˶��ϰ����й��쳣����֪�������˵ȶ����ٴ����֡�
���Ӳ���߷�����׳�꣬Ů�Ը�Ϊ���[1]���ѳ�Ϊ���������˷��������²е���Ҫԭ��[5]�����˿ɼ�������֢״�����Ӳ�����ɵ��»�����ή���ӿ����֪�����ϰ���
���о���ʾ��40%-70%�Ķ��Ӳ�����ߴ�����֪�����ϰ�[6]������֪ˮƽ���½����ڶ��Ӳ�����ڡ��������˶�֢״����֮ǰ���ѷ���[7]����֪�����ϰ������Ἣ��Ӱ����Ӳ�����ߵ����������;�ҵ��[8]������Զ�ڲм���չҲ������������ԡ�һ������ǰհ���о�����[9]�����Ӳ������������֪��������Խ�ͣ��м���չԽ�졣����ή���������ǻ���ή���ǵ�����֪�����ϰ��Ĺؼ���������[10],[11]��Ҳ����Ϊ��ˣ�����������ǵ�III���ٴ��о���"ȫ��������ʧ"��"Ƥ�����������ʧ"��"����������ʧ"��������Ϊ�о�Ԥ���յ㣨��Ҫ�յ��̽�����յ㣩��֤�ݼ������[12],[13]����Ҳʹ���������dz�Ϊ���ڴ��ģIII���ٴ��о���"ȫ��������������ʧ"�Ķ��Ӳ�������������ƣ�DMT��ҩ�
�˴λ�������SUNBEAM��12���£���RADIANCE��B���֣�24���£��������������ҩ�����III���о�������о�����������2600�������ߣ�ּ�������������ǣ��ڷ���ÿ��һ�Σ��Ա�AVONEX®�������˸�����β-1a������ע�䣬ÿ��һ�Σ��¼��"������β-1a"�������Ƴ��˸����Ͷ��Ӳ�������е���Ч�ԺͰ�ȫ�ԡ��о������ʾ[12],[13]���������β-1a��ȣ��������ǿɴ��������ٴ����棨����������ݿɲμ���ĩ"����SUNBEAM��RADIANCE�о�"���֣�:
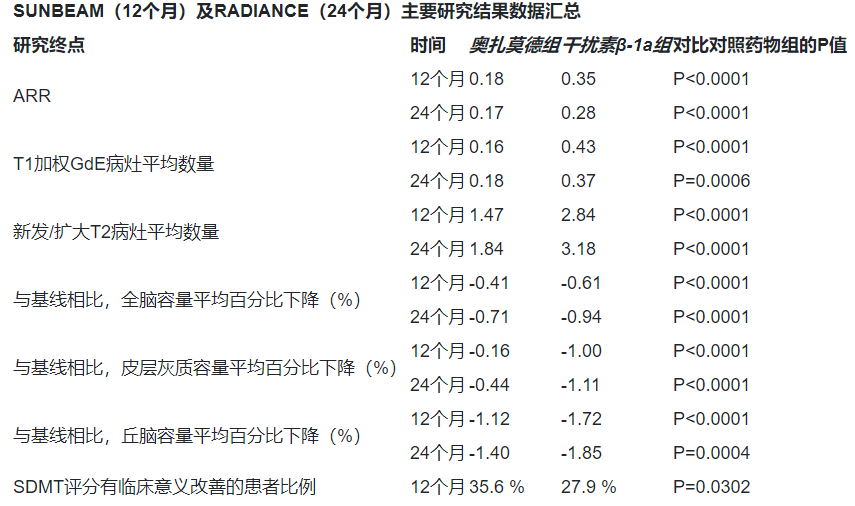
• �긴���ʣ�ARR�����ͣ��������β-1a��ȣ���������������������12���µĻ��ߣ���ARR�ɽ���48%����������24���£�ARR����38%��
• MRI���������٣��������β-1a��ȣ���������������������12���µĻ��ߣ���T1��Ȩ����ǿ��GdE������������63%���·�/����T2����������48%����������24���£���T1��Ȩ����ǿ��GdE������������53%���·�/����T2����������42%��
• ��������ʧ���٣��������β-1a��ȣ�����������������12���µĻ��ߣ���ȫ��������ʧ����31%��Ƥ�����������ʧ����84%������������ʧ����32%����������24���£���ȫ��������ʧ����26%��Ƥ�����������ʧ����60%������������ʧ����27%��
• ��֪���ܱ�������SUNBEAM�о��У�����������������12���£�35.6%���ߵķ�������ģʽ���ԣ�SDMT�����־����ٴ�����ĸ��ƣ�SDMT��������≥4�֣������ڸ�����β-1a�����黼�ߣ�27.9%����
���������о��У������������尲ȫ�Ժ����������ã�����IJ����¼���������≥4%��Ϊ�Ϻ�������Ⱦ����ת��ø���ߡ�ֱ���Ե�Ѫѹ����·��Ⱦ����ʹ��Ѫѹ[14]��
�Ϻ���ͨ��ѧҽѧԺ�����ʼ�ҽԺ���ڿ����Ρ��й�ҽҩ���\��Э�������������ֻ�����ίԱ���й�ҽʦЭ�����ڿ�ҽʦ�ֻ�������ѧ���鳤����̫������ʾ��"���Ǻܸ��˿�������Ī���ڽ������ʡ�����MRI��������������ή��������֪���ܵȷ���չ�ֳ����õ��ٴ����棬Ҳ�ڴ����Ʒ��ij��ֿ����ƶ��ҹ����Ӳ�����������Ŀ�������Ϊ����й����Ӳ�������ṩ���������ѡ��"
�����������õ���Ч�Ͱ�ȫ���������û���������ء���Ϊһ��ȫ�·��ӽṹ�ĸ�ѡ����S1P1��S1P5������ڼ����������ǿ��ʶ������ܰ�ϸ��Ǩ�����������ԣ���ֱ��������������п������������⣬ҩ���лƽ�ȡ�;���㷺����������������⣨�ش���Ѫ�ܼ������߳��⣩�ͻ����⣬�����������ơ�
��ʱ��ʩ���ܲá��й������������г��ܾ������й����ܲó�˼ԨŮʿ��ʾ��"������Ӳ�����߶��Ǽ�ͥ������‘��������'���������������幦���ϰ��Ἣ��Ӱ�����ǵĹ����������֪�����������Ǹ����صĴ������ĥ�����������dz����ء���ʱ��ʩ���й������Ӳ����Ϊ����������������������㣬�ڴ��������ǵĵ�������Ϊ�й������ṩǿ������֧�ֺͱ������ػ����ǵ�������������һ�������ǽ�Я�ָ���������ȫ������ҩ��ɼ��ԡ�δ��������Ҳ��������ѧ��������������������‘�й�2030ս��'��һ���ڳ�ŵ��"
�����Ϸ��ƹ���;���������˽����ҽѧרҵ��Ϣ������ѯҽ������רҵ��ʿ��
���ڶ��Ӳ��
���Ӳ����һ����������ϵͳ���������ʲ���Ϊ��Ҫ�ص�����߽鵼�Լ������䲡���в���ȷ���������Ŵ���������������Ⱦ�ȶ����������[1]���������˻���Ŵ���������������λ֮���ͨ��[3]�����յ���������������һ����Ŀǰ�в�����[15]��
�����Ͷ��Ӳ��֢�����ٴ������ۺ���������-�����ͼ����ͻ�Լ̷���չ�ͼ���[16]�����У�����-�����ͼ��������ʱ��������ͣ�80%-85%�Ļ��߳���ʱ�����Ϊ����-�����ͼ����������Ϊ���Եĸ����ͻ�����̣�ÿ�η�����������ָ��������������������֢[1]��Լ10%-15%�Ļ��߱����Ϊ��չ�ͼ���[16]��
����SUNBEAM��RADIANCE�о�
SUNBEAM�о���RADIANCE�о���Ϊȫ������ġ������˫ä������ҩ��ƽ�ж��յ�III���ٴ��о���ּ����������Ī�����ֿڷ�������0.92mg��0.46mg��ÿ��һ�Σ��������β-1a��ȣ����Ƴ��˸����Ͷ��Ӳ�����ߵ���Ч�Ͱ�ȫ�ԡ�ǰ�߹�����1346�����ߣ�Ϊ��12���£����߹�����1320�����ߣ�Ϊ��24���¡�
������������®���������Ī�½��ң�
����������һ�ֿڷ��ʰ���1-���ᣨS1P��������ڼ����ɸ��������S1P����1��5��S1P1��S1P5��[14]���������ǿ��ʶ������ܰ�ϸ��Ǩ������������Ѫ���ܰ�ϸ������[14]���������ǶԶ��Ӳ�������������õĻ����в���ȫ��ȷ������������ܰ�ϸ����������ϵͳ��Ǩ�����[14]��
����������ȫ����ͬʱ���������Ͷ��Ӳ���������Խ᳦����������Ӧ֢��S1P������ڼ�������ʳƷҩƷ�ල�����֣�FDA���ֱ���2020��3�º�2021��5�������������������Ƴ��˸����Ͷ��Ӳ��֢���ж����ضȻ�������Խ᳦�׳��˻��ߣ�ŷ��ίԱ�ᣨEC����ֱ���2020��5�º�2021��11�����������������������ٴ���Ӱ��ѧ��������Ļ�Ը��������Ͷ��Ӳ��֢���˻��ߺͶԳ����Ʒ��������Ƽ�Ӧ���㡢ʧӦ������ܵ��ж����ضȻ�������Խ᳦�׳��˻��ߡ�
���⣬��������������ƿ��������ٴ��о�Ҳ����ȫ��Χ�ڿ�չ�С�
ע���������������Խ᳦�Ϳ�������Ӧ֢��δ���й�����
���ڰ�ʱ��ʩ���й�
��ʱ��ʩ����һ����"�з����ṩ����ҩ���������սʤ���ؼ���"Ϊʹ����ȫ����������ҩ��˾�����й�����˾�ڸ���������������������ҵ���ȵ�λ����������������������ѪҺѧ������ѧ����������ͻ���Դ��²�Ʒ�������ѧ���ı仼��������
�»�����ŵҽ���ǰ�ʱ��ʩ��˾��ȫ���ӹ�˾������������IJ����г������ڵ��ط��ɣ��»�����ŵҽ�Ʒֱ𱻳�֮Ϊ�»�-- һ�Ұ�ʱ��ʩ�Ĺ�˾����ŵҽ�� -- һ�Ұ�ʱ��ʩ�Ĺ�˾��
[1] �����Ӳ����Ϻ������й�ר�ҹ�ʶ��2018�棩�����й�������ѧ����ѧ��־2018��11�µ�25����6�� Chin J Neuroimmunol & Neurol 2018��Vol.25��No.6��387:394
[2] National Multiple Sclerosis Society. Definition of MS. www.nationalmssociety.org/What-is-MS/Definition-of-MS. Accessed on March 25, 2020.
[3] National Multiple Sclerosis Society. What is Myelin? www.nationalmssociety.org/What-is-MS/Definition-of-MS/Myelin. Accessed March 25, 2020.
[4] National Multiple Sclerosis Society. MS Symptoms. www.nationalmssociety.org/Symptoms-Diagnosis/MS-Symptoms. Accessed March 25, 2020.
[5] MS Atlas Report 2013. http://www.msif.org/wp-content/uploads/2014/09/Atlas-of-MS.pdf. Accessed May 24, 2017.
[6] Manca R, et al. J Neurol Sci. 2018;388:115-127.
[7] Sumowski JF, et al. Neurology. 2018;90:278-288
[8] Campbell J, et al. Postgrad Med J. 2017;93(1097):143-147.
[9] Deloire, et al. Multiple Sclerosis 2010;16:581–587.
[10] Sormani MP, et al. Mult Scler. 2017 Apr;23(5):656-664.
[11] Pitteri M, et al. Mult Scler. 2017;23(6):848-854.
[12] Comi, G, Kappos, L, Selmaj, KW, et at. Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (SUNBEAM): a multicenter, randomized, minimum 12-month, phase 3 trial. The Lancet: Neurology. DOI: 10.1016/S1474-4422(19)30239-X.
[13] Cohen, JA, Comi, G, Selmaj, KW, et al. Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (RADIANCE): a multicenter, randomized, 24-month, phase 3 trial. The Lancet: Neurology. DOI: 10.1016/S1474-4422(19)30238-8.
[14] ZEPOSIA (ozanimod) capsules for oral use. Bristol Myers Squibb Pharmaceutical Corporation. Full prescribing information. 3/2020.
[15] National Multiple Sclerosis Society. What Causes MS? www.nationalmssociety.org/What-is-MS/What-Causes-MS. Accessed March 25, 2020.
[16] National Multiple Sclerosis Society. Types of MS. www.nationalmssociety.org/What-is-MS/Types-of-MS. Accessed March 25, 2020.
����Ȩ�������������ɵ��������������ݽ���Ϊ�������뱾��վ�ء����ĵ�ԭ�����Լ����г������ֺ۵�δ����վ֤ʵ���Ա����Լ�����ȫ�����߲������ݵ���ʵ�ԡ������ԡ���ʱ�Ա�վ�����κα�֤���ŵ������߽����ο���ת�ش����dz��ڴ��ݸ�����Ϣ֮Ŀ�ģ���������������ͬ��۵�Ͷ�����ʵ�Ը���������ֱ�վ�����ӳ�Ϯ�����ݣ����ṩ���֤�ݣ�һ����ʵ����վ������ɾ��������Ȩ���ݡ�